Ce protocole m’a permis de réalise une mesure par semaine environ, en 2021. Le résultat se trouve dans l’article dédié.
S’il y a traitement vermifuge, il est fait après le prélèvement de la semaine considérée.
Prélèvement (week end)
Prélèvement en différents endroits du crottin et si possible sur plusieurs crottins (de moins de 12h) quelques grammes (à l’aide d’une fourchette).
Le prélèvement est fait à l’intérieur du crottin, pas en surface (moindre exposition à l’oxygène et aux influences extérieures).
Il est mis dans un tube Falcon 50mL, masse totale de crottin entre 10 et 20g.
Stockage
emmène au labo le lendemain. Les échantillons sont réfrigérés la nuit, mais transportés et stockés à température ambiante en attente de l’analyse que je fais dans la journée. Le stockage est fait directement dans les tubes de préparation ne permet pas un stockage anaérobie, mais est un gain pratique très appréciable.
Analyse (lundi)
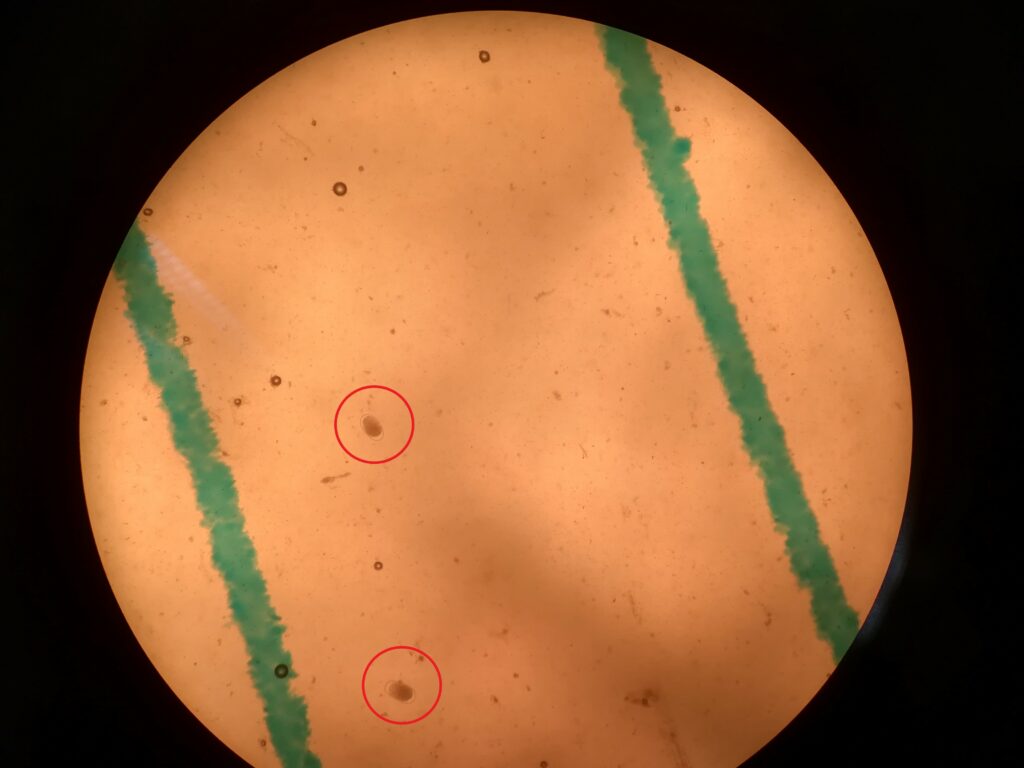
Les tubes contenant le crottin sont pesés (détermination de la masse de crottin). J’ajoute 30 mL de solution de chlorure de sodium (sel de table) saturée. J’utilise un vortex de laboratoire pour bien homogénéiser. Je fait couler le liquide directement du tube dans la cellule de McMaster.J’attends quelques minutes. Je compte sous le microscope (objectif 10x) le nombre d’œufs.
OPG = nombre d’Œufs Par Gramme = nombre d’oeufs comptés sous une grille x100x2/masse de crottin
Remarques
Le protocole de Mc Master initial est une dilution de 1g de crottin dans 15mL de solution salée à saturation (voir par exemple la fiche coproscopie de l’IFCE).
Comme je ne veux pas manipuler le crottin une fois mis dans le tube, j’utilise la masse collectée totale « m » (entre 10 et 20g), mon échantillon sera donc « m » fois plus concentré que ce que recommande le protocole initial.
Pour arriver à l’homogénéiser dans la solution de flottation, 15 mL ne suffisent pas, mais 30mL conviennent à peu près (dilution 2x par rapport au protocole initial – le mélange reste assez dense).
La formule modifiée, donnée ci-dessus, tient compte de tout cela.
Ce protocole minimise la manipulation du crottin après prélèvement initial (moins d’odeur, moins de nettoyage, préparation plus rapide….)… en bref, cela le rend tenable dans mon emploi du temps.
Matériel
Cellule de Mc Master Eggzamin – 31 dollars frais de port inclus.
Un microscope.
Tubes Flacon 50 mL (consommables de laboratoire).
Un vortex (équipement de laboratoire) (ça secoue les tubes pour mieux mélanger).
De l’eau et du gros sel.